| (2012.6.3) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 【参考資料】ヒロシマ・ナガサキ・フクシマ | |||||||||||||||||||||||||||||||||||||||||||||||||

|
|||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章6.6節 ホルミシス応答 | |||||||||||||||||||||||||||||||||||||||||||||||||
「ホルミシス」とはいったいなんだろうか? 公益財団法人・高度情報科学研究機構(RIST)は、『1981年に設立された財団法人原子力データセンター(NEDAC)を起源とし、1995年に組織改編を行い、法人名を現在の名称に改名しました。・・・これまで原子力、地球環境等の分野における情報科学技術の高度化、大規模計算機の利用技術の開発、原子力分野のコード・データベースの提供などで多くの実績を上げ、この分野での発展に貢献しています。』(<http://www.rist.or.jp/>「RISTの紹介」より)と高らかに謳いあげるように、日本における「核推進勢力」のデータベース・センターである。 その高度情報科学研究機構が運営する原子力百科事典が「ATOMICA」であり、私なども非常にしばしばお世話になっている。『「核推進勢力」の運営する百科事典を参照するとは何事か!』と怒る人がごくたまにだが、居る。しかしそれは完全な誤りである。「核推進勢力」であろうがなかろうか、体系的で根拠のある情報や知識は有益であり、そうでないものは「無益・有害」である。「核反対勢力」であっても「非体系的で根拠のない情報や知識」を垂れ流すなら、それは無益で有害である。まさに「白かろうが、黒かろうかネズミをとってくる猫がいい猫」なのだ。問題はそうした「体系的で根拠のある情報を、根底から批判する新たな体系構築であり、その根拠の再検証であり、それに由来する新たな発見または解釈」だ。私はこのECRR2010年をそうしたものとして読んでいる。 「ATOMICA」は「ホルミシス」という項目で次のように説明している。
従って、「ホルミシス」とは通常は生物に対して有害だが、ある特殊な状況(この場合は少量、微量。あるいは他に条件があるのかもしれない)においては生物に対して有益な効果をもたらす現象と解釈することができる。 現在ただ今の問題としては、この現象が「だから、低線量被曝は体に有害どころか、有益だ」という論拠に使われていると言うことである。「ある特殊な状況」を一般化して外延する典型的な詭弁論法である。古代中国、古代ギリシャの昔から散々使われてきた手口である。 しばらく「ATOMICA」を続ける。「放射線ホルミシス」という別項目では概要として次の説明を与えている。
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| 「ホルミシス」に勢いづいた核推進勢力 | |||||||||||||||||||||||||||||||||||||||||||||||||
「核推進勢力」が「ホルミシス」に勢いづいた様子が窺える。このATOMICAの「放射線ホルミシス」の本文説明をわかりやすくかみ砕いて、もっと傍観者的に扱ったのが日本語ウィキペディア「放射線ホルミシス」である。次に長くなるかもしれないが、それを引用する。
なるほど説得力のある議論である。そして1978年ミズーリ大学のラッキー博士のネタもとが『ホルミシスという言葉が最初に用いられたのは菌類の成長を抑制する物質が低濃度では菌類の成長を刺激することを表現するものとしてであり、「少量の毒は刺激作用がある」とするアルント・シュルツの法則(Arndt-Schulz rule)の言い直しである。』と「シュルツの法則」にあることも説明している。(だとしてもラッキーの業績はゆるがない。シュルツの法則を電離放射線に適用して見事にあたったのだから)
「原爆は健康を促進した」というのは、被爆者の中に長寿の人が多いことを指しているようだ。
ここでのヤブロコフの主張は次のようになる。
日本語ウィキペディア「放射線ホルミシス」の引用を続ける。
これは「ATOMICA」の主張でもある。
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| ホルミシスの線量範囲 | |||||||||||||||||||||||||||||||||||||||||||||||||
この日本語ウィキの記述で注目されるのは、「ホルミシスが生じる線量範囲 」という項目である。ホルミシス効果が「ある特殊な状況」で起こるなら、その特殊な状況を定義しなければならない。この項目は「ある特殊な状況」の一つを「被曝線量範囲」に求めようと試みた項目である。
ラッキーの範囲は非常に広く、これでは事実上ほとんどの放射線被曝に「ホルミシス効果」が認められることになる。
電力中央研究所の服部の見解もほぼラッキーを全面的に認めている。
全米科学アカデミーのチームは、曖昧ではあるが恐らくその範囲は100mSv以下であろうとしている。また環境科学技術研究所は1日20mSv以下であろうとしている。
放射線影響協会は、恐らくは累積で13.3mSv以下であろうことを示唆している。要するに、「ホルミシス効果」は認めるものの、その効果が発現する「特殊な条件」については被曝線量範囲を含め、まだ定まった説はないということであろう。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 細胞修復効果の上昇 | |||||||||||||||||||||||||||||||||||||||||||||||||
さてここまで予習をしておいて、ECRR2010年勧告の記述を見てみよう。
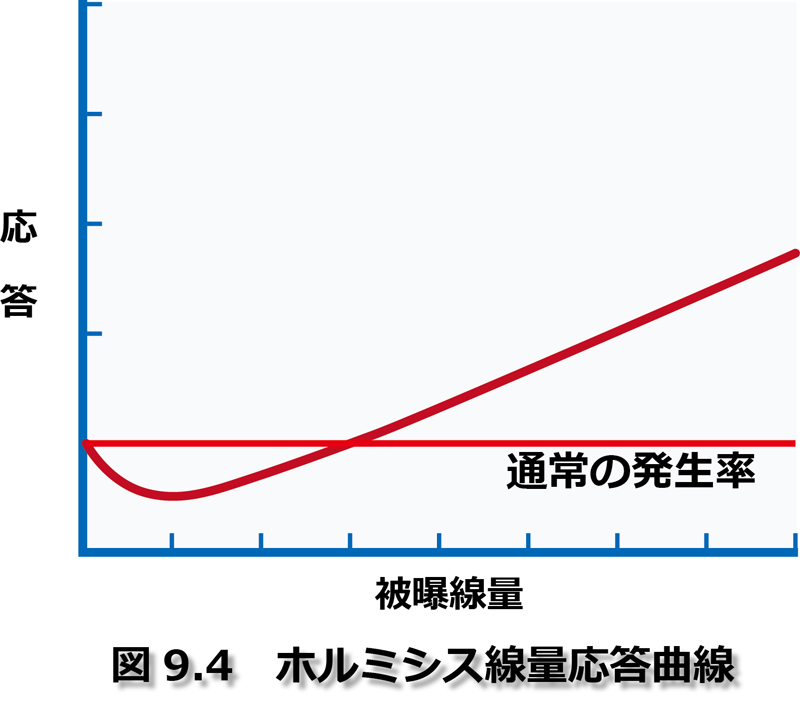
以下が図9.4である。
結局、ECRRもホルミシス効果はありうるものと認めている。しかしこの効果は中間的な線量(20mSv以上)で現れている、ともしている。そして次のように結論している。
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章7節 放射線作用の生物学的効率に影響する因子 | |||||||||||||||||||||||||||||||||||||||||||||||||
「放射線作用の生物学的効率」とは放射線による生物に対する影響、損傷のことである。どんな因子が影響しているのかを論じた短い節で、ここまでのまとめにも似た内容となっている。
この意味では、「損傷」は一種の物理量として表現される。たとえば、「Sv=実効線量」などは典型的な物理量だろう。
(本文テキストでは「表9.4」と表記されているがこれは「表9.5」の誤植) 表9.5 放射線損傷から「がん」へ進展するに際して影響する因子(ファクター) (なお左端の1,2,3の通し番号は私が便宜のためにいれたものである。また青字の小さめフォントの記述は私の入れた説明である)
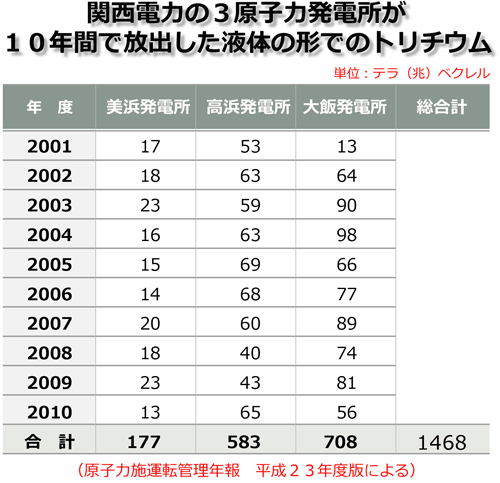
2.の「トリチウムのような弱い崩壊」が電離密度増加の因子としてあげられているのは注目に値する。というのは全ての原子力発電所は、通常運転の中で大量のトリチウム(三重水素)を発生させ、これを不可避的に環境に放出しているからだ。独立行政法人原子力安全基盤機構が毎年公表している「原子力施設運転管理年報平成23年度(2011年度)版によると、関西電力は美浜、高浜、大飯の3原子力発電所から2010年度(2010年4月~2011年3月)の1年間で13.4兆ベクレルのトリチウムを液体の形だけで(つまり若狭湾に)放出している。また3原発合計で2001年度から2010年度の10年間に合計146.8兆ベクレルのトリチウムを液体の形で放出している。(以上「原子力施設運転管理年報について」を参照のこと) 「電磁場相互作用」は、電離放射線で細胞の中の分子や原子がイオン化されることによって発生する。本来中性で安定していなければならない細胞の分子や原子がイオン化されるために、電磁場が生ずる。この電磁場が他の分子や原子(つまり健全な細胞)にも影響を与える。
空間線量が増加すれば、被曝線量が増加するだろうことは容易に見て取れる。(1.)フクシマ放射能危機で特に空間線量の高い地域(福島県中部・東部、茨城県北部など)はたちまちこの危険に曝されている。しかしそれより恐いのは「2.点線源による内部被曝」で、体の中に入った放射性物質が臓器や器官に付着してしまうことだ。このばあい点線源というのは数ナノメートルから数ミクロン(10億分の数メートルから百万分の数メートル)単位の話である。体の外に出てしまえばいいが、体の中に残ってしまえば核崩壊が終わるまで、事実上一生涯体の中で放射線を出し続けることになる。この中で特に恐いのは「ホット・パーティクル」だ。酸化プルトニウムのような不溶性(水にとけない)のきわめてエネルギーの高い微粒子(数ミクロン単位)のことだ。水に溶けないため体外に排出しにくい。しかし(2)のケースも(3)のケースも1回切りの摂取ではなく、毎日摂取する環境(慢性被曝環境)は是非とも避けなければならない。「4.不動の崩壊系列による内部被曝」というのは、体の内部で決まった核崩壊をする核種による内部被曝という意味だ。典型的にはストロンチウム90(Sr-90)だろう。ストロンチウム90はウランやプルトニウムなどの核分裂から生まれる。(従って原子炉の中には大量のストロンチウム90がある)非常に不安定な同位体であるストロンチウム90はベータ線を出しながら核崩壊してイットリウム90(Y-90)になる。イットリウム90もまた不安定な同位体でこれもベータ線を出しながら核崩壊してジルコニウムになる。しかもイットリウム90はベータ崩壊核種でありながら透過力も強く、日本語ウィキペディア「ストロンチウム90」によると水の中でも10mm程度飛程するという。「5」、「6」については後ほどの節で説明がでてくる。
「2」の項目、すなわち空間における因子がほぼそのまま、時間における因子ともなる。これは慢性被曝状態を想定してみれば、ただちに了解されよう。日本政府やICRP派の学者や研究者の説明は、ほぼこの時間的要素を無視している。つまり彼らが「低線量被曝は人体に有害ではない」という時のさまざまな説明は、ほぼ「時間的因子」を無視して「一回きり被曝」のケースを持ち出していることが多い。
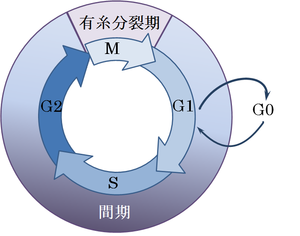
細胞周期のモデル図
前出の細胞周期の問題だけを取り出した箇所。当然その細胞が損傷を受けたことがあるかどうか大きな因子となる。
細胞修復機能そのものが低下している状況も因子として考慮しなければならない。中でも大きな要素は遺伝的要因である。たとえば前出放射線感受性が高い遺伝子としてATM遺伝子に触れたが、ATM遺伝子をもった細胞はもともと細胞修復効率が低い、ということも考えられる。「抗酸化物質の状態/修復酵素の状態」と「修復システム触媒の濃縮」についてはこの後の説明に出てくる。
この一覧表は、「がん」への進展に影響する因子について考えている。その点では、「がん化」する細胞を抑制する機構が正常に働いているかどうか、またその機能が低下しているかどうかが大きな要因でもある。その表ではその因子として、「高い局所線量」(もちろん臓器や器官の話ではなく細胞の話である)、と先ほども出た「ホット・パーティクル」(きわめて危険な微粒子)があげられている。 これで見ておわかりのように、「がん化」を促進する内部被曝の因子やプロセスは決して一本調子ではなく、さまざまな因子が複雑かつダイナミックに絡まり合って進展している。ICRPの言うように、「放射線核種は特定の器官や臓器に集まりやすく、また1Svの被曝ででは100人に5人ががんを発症し死に至る可能性がある。しかし100mSv未満の被曝では、人体に害があるという科学的証拠は今のところ存在せず、おそらくは害がないだろうと思える。」という説がいかにも、直線的・単純素朴で、牧歌的にすら聞こえてくる。 現在ただ今の問題は、このICRPの全く時代錯誤的な放射線防護勧告に基づいて「フクシマ放射能危機」が対処されているということだ。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章8節 セカンド・イベント理論 | |||||||||||||||||||||||||||||||||||||||||||||||||
生きている有機体(つまり生物全体)はほとんどの場合非複製モードにある。(先ほどの細胞周期のモデル図で“G0”の状態) しかしながら老化や臓器の成長、あるいは細胞損傷によってある一定程度の小さな割合の細胞は複製モードに入っている。この一連の流れ(シークエンス)は、G0-G1(細胞複製の信号を受け取った状態)-S(細胞複製中)-G2(複製が終了し有糸分裂への準備状態)-M(有糸分裂中)というプロセスで表現できる。このシークエンスには10時間から15時間程度の時間がかかる。このシークエンスの中で損傷に対して複製中(S期)の放射線感受性はきわめて高い。そのため細胞死にいたることもある。 チャイニーズ・ハムスターを使った実験では、卵巣細胞に低LET(Linier Energy Transfer-線エネルギー付与)の放射線を照射すると、上記シークエンス中の細胞は非複製モードの細胞と比べると、細胞死に関する感受性は600倍も高い。このことは、複製モードにある細胞が感受性がきわめて高く、突然変異の確率もきわめて高いことを示唆している。 ある細胞が低線量放射線のヒットを受けたとする。その細胞はただちに修復しようとするだろう。そして前述の手順に従って、細胞複製モードに入るであろう。そして細胞修復に成功するであろう。しかし、この細胞修復中に、すなわち10時間から15時間の間にもう一度2回目のヒットを受けたらどうなるだろうか?それは、非常に大きなリスクを伴うことになる。これが「セカンド・イベント」理論(仮説)である。従って厳密にはセカンド・イベント理論とは、同じ細胞が短時間のうちに2回、3回とヒットを受けることではなく、最初のヒットで細胞修復のサイクルに入り、細胞複製中に2回目のヒットを受けることである、ということになる。実際短時間の間に同じ細胞が2回、3回とヒットを受けるのは、内部被曝の場合まれなケースではなく、逆に通常起こるケースなのだ。 日本の電気事業連合会やICRP系の学者や研究者がよく使う説明、すなわち「細胞は放射線を受けても、細部修復機能があるので細胞は損傷を受けません」というのは、2回目のヒットが細胞修復中(すなわち細胞複製中)になかった場合のケースの話であり、外部被曝の場合は通常起こりえても、内部被曝の場合はきわめて希である。
今のところICRPはこのセカンド・イベント理論を全くと言っていいほど無視している。 実際内部被曝の場合、このセカンド・イベント効果はありうる話だ。第9章8節は、セカンド・イベント効果による内部被曝リスク増大のケースを次のようにいう。
前述のように、非常に不安定な同位体であるストロンチウム90はベータ線を出しながら核崩壊してイットリウム90(Y-90)になる。イットリウム90もまた不安定な同位体でこれもベータ線を出しながら核崩壊してジルコニウムになる。イットリウムの物理的半減期は64時間だから、もしストロンチウム90を体内に取り込めば、細胞複製期間中に2回目のヒットを受けるのはほぼ確実といわねばならない。ここではストロンチウム90が例にあげられているが、そのほかにもセシウム137や134など系列崩壊する核種は多い。
要するに低レベル放射線の細胞に与える影響については、そのメカニズムやモデルはまだまだ仮説の段階にとどまっている、これから更なる研究が必要だと、といっているわけだが、当然すぎるほど当然な話だ。同時にこれからの研究の方向は従来型の疫学的研究に加えて、分子生物学的な研究、細胞や遺伝子に関する研究、さらに病理学的な研究、とその方向性を拡げ、発展させていかなければならないことも明白だろう。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章9節 がん発現に影響するその他の因子 | |||||||||||||||||||||||||||||||||||||||||||||||||
放射線の細胞に対する影響(直接的にはがん発現)は、これまで見てきた要因(因子)ばかりではない。そのほかにも数多くある。この節ではそのうち2つ、「免疫監視機構」(第9章9.1節)と「細胞分裂増殖場」(9.2節)を取り上げている。 「免疫監視機構」を理解する前に「免疫」(immunity)とは何かをしっかり理解しておこう。日本語Wikipedia「免疫(医学)」は次のように説明する。 『感染、病気、あるいは望まれない侵入生物を回避するために十分な生物的防御力を持っている状態を指す。』 つまり、体の外からやってくる生物(侵入生物)から防禦すること、あるいは防禦の状態を指す言葉だ。免疫には2種類のタイプがある。ひとつは「障壁として働いたり、抗原特異性に拘わらず、広い範囲の微生物を排除する働きをもつ」免疫である。別に特定の生物に対応した免疫ではないから「非特異免疫」と呼ばれている。ふたつ目は「特異免疫」で、ある特定の「遭遇した新しい病気各々にそれら要素を適応させて病原体特異的な免疫」のことだ。 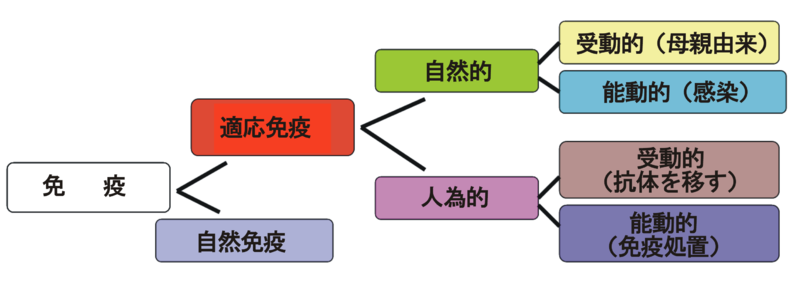 それでは生物は「免疫」をどうやって獲得するか、という問題になる。前出の「免疫(医学)」は自然に獲得する免疫と状況に応じて獲得する免疫があるという。状況に応じて獲得する免疫を「適応免疫」というらしい。適応免疫はまた人為的に獲得する免疫(たとえば予防注射)と自然に獲得する免疫(例えば母親から受け継ぐ免疫)とがあり、これらを表にまとめてくれているので上に示す。 第9章9節では「がん発現」に関する「免疫」のことだから、「特異的免疫」の話と言うことになる。
それは当然だろう。細胞の突然変異から「がん発症」までにはさまざまな要因やプロセスがあるに違いない。
つまり人体は免疫系を備えており、細胞の突然変異から腫瘍に進展しさらにこれが「がん」に進展するのを抑制するシステムがある、ということだ。 この「がん」に対する免疫監視システムが抑制される(衰える)とがんのリスクが高まる、ということになる。現在ただ今の問題としては、電離放射線への被曝が「免疫監視システム抑制」の原因因子になっているのではないか、ということである。なおこの要因はICRPによっては全く議論されていない。しかし、実際にある、ということは立証されている。(たとえば紫外線による皮膚のがん化。紫外線は電離放射線とは分類されていないが弱い電離エネルギーをもっている。)
なお、世界の医学界共通のホットな研究テーマはもちろん「がん」の研究である。なかでもここで取り上げられている「監視抑制機構」の研究は急ピッチで進められており、監視抑制機構の働きが明らかになるにつれて、被曝、特に内部被曝が「がん化」にどう影響するかはもっと具体的に明らかになってくると思われる。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 細胞分裂増殖場 | |||||||||||||||||||||||||||||||||||||||||||||||||
ここでのもうひとつの話題、「細胞分裂増殖場」(9.2節)について見てみよう。
このことから、がんが成長するためにはその成長の場(この場合は組織)に一定以上の数の、遺伝子的損傷を受けた細胞の存在が必要になるのではないか、という仮説が出されている。この効果のことを『細胞通信場の効果』(cell communication field effect)と言うそうだ。この細胞間通信にはさまざまな要素が関与している、とゾーネンシャインとソトは仮定している、と9.2節はいう。 ゾーネンシャインはタフツ大学・医学部の解剖学・分子生物学教授のカルロス・ゾーネンシャイン(Carlos Sonnenschein)のことだ。またソトは同じく医学部分子生物学教授、アナ・ソト(Ana M. Soto)である。二人は1999年に、「細胞の社会:がんと細胞増殖の統御」(The Society of Cells: Cancer and Control of Cell Proliferation)という本(研究論文)を発表し、この「細胞通信場」のことを論じている。(そうだ。もちろん私は読んだこともない。たとえ読んだとしても理解できないであろう)
もちろんゾーネンシャインもソトもICRPでもECRRでもない。大体二人は分子生物学者なのだ。放射線とはまったく関わりない。しかし、ECRR派の学者や研究者は、分子生物学(そのテーマは細胞)の最先端の研究から学ぼうとしているのに対して、ICRP派の学者・研究者にはその姿勢が見られないと言うことだ。2000年に入って、世界的にICRP派の学者も分子生物学を手掛けだした。日本で言えば広島大学の原医研や千葉の放医研などである。しかし彼らの研究の目的は、ICRP学説を分子生物学の立場から強化・補強しようというので、そもそも目的が違っている。大きな成果は期待できそうにない。
低線量放射線被曝、特に内部被曝の研究においては、「科学的にわからないことが多い」と澄ましていないで、もっともっと分子生物学的アプローチを素直に継続していく必要があるだろう。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章10節 生化学的および生物物理学的効果 | |||||||||||||||||||||||||||||||||||||||||||||||||
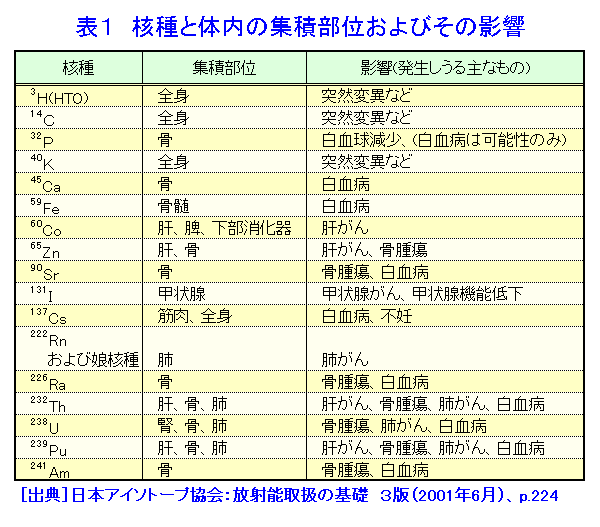
ここもECRRとICRPをくっきりわける「放射性物質観」である。ICRPはいまだに、特定の核種は特定の臓器や器官に蓄積するなどと時代錯誤的なことを言っている。たとえば、下表は日本アイソトープ協会がまとめた「核種と体内の集積部位」の表である。
この表ではセシウム137(137Cs)は筋肉と全身に集積するのだそうだが、下表はベラルーシのユーリ・バンダジェフスキーが高濃度汚染地域(チェルノブイイリ事故で汚染されたベラルーシのゴメリ地区)で亡くなった乳児を解剖して、集積したセシウム137の臓器別集積表である。ちなみにがんで死んだ乳児は1人もいない。(「子どもたちの臓器におけるセシウム137の慢性的蓄積」を参照のこと) 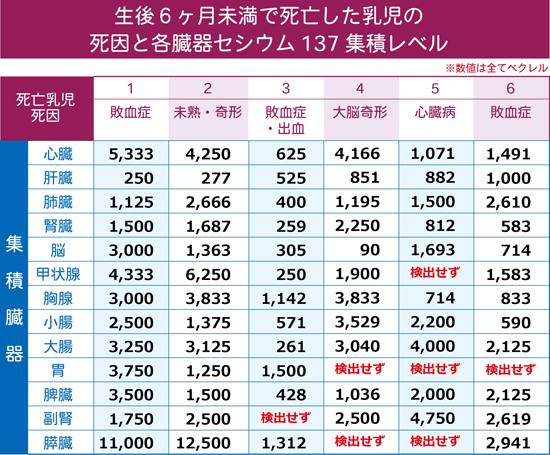 死に至る乳児には各臓器に大量のセシウム137の集積が見られる。「だから全身と断っているじゃないか」というかもしれないが、それは「全身に蓄積する」などという言い方が全く科学的ではないことを自ら認めたに過ぎない。 さすがにECRR2010年勧告は紳士であり上品であるから私のような悪態はつかずやんわりと次のように言っている。
要するに臓器を構成している細胞と特定の核種に親和性があるのであって、特定の臓器に集積しやすいと考えることは、もっと重大なことを見逃しがちになるとECRRはいうのである。たとえば、
界面吸着とは、『物体の界面において、濃度が周囲よりも増加する現象のこと』(日本語ウィキペディア「吸着」)である。吸着は『気相/液相、液相/液相、気相/固相、液相/固相の各界面で生じうる。』(同) したがってここで云っていることは、細胞とそれを取り巻く液体や気体の界面にセシウム137が吸着しやすい、すなわち濃縮されて局被曝線量が増加するだろうことを言っている。また神経信号系に含まれた正イオン(プラスのイオン。原子や分子からマイナスの電荷をもつ電子が電離されれば、その分子や電子はプラスの電荷をもつイオンとならざるを得ない)は、シナプス接合部に集まるが、それは接合部に局所被曝線量を増加させるだろう、と述べている。(p99) いずれにせよ、ある核種は特定の臓器に集まりやすく、そこにがんを発症させやすいなどという話は、もっともらしいお伽噺である。放射性物質の体の中の動きは、それほど単純素朴ではない。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章11節 元素転換 | |||||||||||||||||||||||||||||||||||||||||||||||||
これまでこの第9章の各節で、体内に取り込まれた放射線核種は、ストロンチウム90にしろ、セシウム137にしろ、ヨウ素131にしろなんにしろ、核崩壊し別な核種となって場合によればさらに核崩壊し、また電離エネルギーを放出しながら細胞を2度3度と傷つけていくことを見てきた。すなわち放射性物質は体内で元素転換し、新たな危険を生んでいくのである。この節ではこれまで述べてきたことを改めて「元素転換」という括りでもう一度まとめて眺め、また新たな観点を加えて検討してみようする節である。このことが必要なわけは、
もし話が外部被曝であれば、このことはほとんど問題にならない。被曝線源から逃れることができるからだ。しかし内部被曝の場合はそうではない。体の中に抱え込んだ放射性物質は、体の外に完全に排出されるまで、相手のなすがままにする以外に方法がないからだ。
それは炭素14(C-14)、トリチウム(三重水素:T-3)、そして硫黄35(S-35)の3つだという。 生命体の担い手は、各種たんぱく質、さまざまな酵素、DNAにしてもRNA(リボ核酸ribo nucleic acid. DNAを鋳型にして転写される。生命を担う重要な因子。生体内での挙動や構造により、伝令RNA<メッセンジャーRNA、mRNA>、運搬RNA<トランスファーRNA、tRNA>、リボソームRNA<rRNA>、ノンコーディングRNA <ncRNA>、リボザイム、二重鎖RNA <dsRNA> などさまざまなRNAが見つかっており分類がなされている。以上日本語ウィキペディア「リボ核酸」から抜粋引用)にしても、巨大分子である。 巨大分子とは、非常に多数の原子が共有結合してできる非常に大きな結合体分子のことである。高分子ともいう。一般的に原子の数が1000個程度以上、あるいは分子量が1万程度以上のものは高分子と見なされているそうだ。(以上日本語ウィキペディア「高分子」による) こうした「巨大分子」は一体どうやって、その機能や生物学的健全性を保つのであろうか?わかりやすく言えば、生命活動の根幹を担うこうした巨大分子はどうやってその正常機能をたもつのであろうか、ということである。 『それらの3次構造、すなわち形状に依存している。』(p99)とECRRはいう。分子結合の形を保つことによって、その機能や健全性を維持していると言うことである。ではその形状が維持できなくなると、どうなるか?『その巨大分子の機能喪失をもたらす。』(同) ここで問題になるのが「元素転換」である。炭素、水素、硫黄といった元素はこうした巨大分子結合では、どこにでも使われている基本要素だ。
1つの巨大分子、それが重要なたんぱく質であろうがDNAであろうがなんでも構わないが、仮に1000個の原子から構成されているとしよう。その1000個の原子の1個が元素転換してしまえば、その巨大分子はもうもとの機能を喪失してしまう、といっていることになる。
普通の水素原子Hならば元素転換は起こらないが、それがトリチウム(三重水素)(3H)ならば、これはヘリウム(He)に元素転換してしまう。当然ヘリウムは分子結合の橋渡しは担えない。従ってトリチウムからヘリウムへの突然の崩壊は、それをパーツとして使っている巨大分子全体の機能不全を意味する可能性がある。実際にこれらの系(水素結合の系)では、水素とトリチウムを容易に交換可能だという。つまりは、巨大分子は本来は安定した水素をパーツとして使わなければならないのに、交換可能なトリチウムを使ってしまうということである。
トリチウムについては、実は私たちは重大な問題に直面している。原発などで使用される原子炉では通常の運転中に大量のトリチウムが発生している。日本の原子力規制では、トリチウムは人体に害がないものとして環境に放出しているのだ。排出規制値もない。青天井で環境に放出している。別表は関西電力が若狭湾に面して所有している3つの原発、すなわち美浜、高浜、大飯の3発電所から2001年から2010年の間に液体の形で排出したトリチウムの量である。下表を見ておわかりのように厖大な量である。電気事業連合会や各電力会社は、「この程度の量では人体に影響はありません」とさかんに宣伝しているが、それはこうした分子生物学的な知見に基づいたものではない。あくまで電離エネルギーの話だ。(電離エネルギーとしてもとんでもないエネルギー量で、なにを根拠に人体に害がないといっているのかわからない。)
もしこの分子生物学的知見が正しいとするなら(私は正しいと思うが)、原発などの核施設は事故を起こすから危険なのではなく、その存在そのものが全ての生きとし生けるものにとって危険、ということになる。(それにしても若狭湾の汚染は一体どうするのか)
そしてこの節を次のように結んでいる。
<この論評というのは1980年(チェルノブイリ事故の6年前)、L.M.グラチェバ(Gracheva LM)とV.G.コロレフ( Korolev V G)が共著で出版した「細胞における放射線核種崩壊の遺伝子的効果」( “Genetic Effects of The Decays of Radionuclides in Cells”)のことを指していると思われる。> |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 第9章12節 胎盤中の微粒子とゲノム信号輸送による 胎児への被曝線量の増加 |
|||||||||||||||||||||||||||||||||||||||||||||||||
母体の血流を通じて胎盤がセシウム137などを吸収し、胎児が被曝して重篤な障害や死産・流産にいたるケースはチェルノブイリ事故でウクライナ、ベラルーシなどで頻発したことはよく知られている。ここでは、その問題ではない。その放射性物質が不溶性の微粒子の場合、たとえば酸化プルトニウムなどの場合、どのくらいの大きさの微粒子なら胎盤を通過するだろうか、という問題である。発育初期の胎児(特に受精から8週間までの胚芽と呼ばれる時期の胎児)にとって、プルトニウムやアクチノイド系列の元素(原子番号89から103まで、すなわちアクチニウムからローレンシウムまでの15の元素の総称。中に原子番号90のトリウム、原子番号91のウラン、94のプルトニウム、95のアメリシウムを含む。全てが放射性元素で、半減期が短いものが多い。トリウムとウランには半減期が数億年以上の長命な同位体が存在するためにまとまった量が天然に存在するが、他の元素は天然には全くまたはごく僅かしか存在せず、ほとんどが人工的に作られたものである。特にウランより重いネプツニウム以降の元素のことを超ウラン元素といい、ほぼ自然界には存在しない。使用済核燃料に含まれている。)からのアルファ線を出す粒子は、ごく微量であっても『その影響は胎児死亡や初期の流産から幼年時代のでの影響までの広い範囲に及ぶかも知れない。』(p100) ところが、『胎盤を通過することのできる粒子の大きさは決められていない。』(p99)さらに最近のまだ未発表の研究によると、100nm(ナノメートル。1ミクロンの1/10)の大きさの粒子は胎盤を通過することができるという。たとえばプルトニウム粒子はアイリッシュ海の周辺(イギリスのウインズケール事故で流出した放射性物質はアイリッシュ海とアイルランドを汚染した)や原発など核施設周辺ではおなじみの汚染物質である。 仮にこうした危険な微粒子が、胎盤を通じて胎児に至らなくても(胎盤がブロックすることができても)、『たんぱく質としてはきわめて小さくバイスタンダー効果の原因であるゲノム不安定信号分子が存在する事が知られている。・・・そのためゲノムおよびバイスタンダー効果は原理的にはまた機構論的に言えば胎盤から胎児へ輸送されそうであり、実際に世代横断的なゲノムの不安定性の効果が現在、チェルノブイリの影響を受けた集団と実験動物において見られている。』(p100) これで第9章全体を比較的丁寧にみてきた。 (私におつきあいいただいて、第9章を読み通されたかたはどれほどいただろうか?決して多い数ではないと思う。) 第9章を学んだ私の感想は、第1に人間の細胞(生きとし生けるものの細胞といってもいいが)の玄妙不可思議さだ。進化の過程で細胞とそれを取り巻くメカニズムは精緻に作られてきた。それと同時に科学や医科学はこの分野ではまだまだ未発達である、と感じる。 第2に感じるのは、こうした人間の細胞とその機構を理解したものとみなして、訳知り顔に「放射線防護体制」の学説とその手順を構築するICRP派の学者の無知と傲慢さだ。彼らは「反原発」を唱える人々に向かって、「情緒的・感情的、非科学的」という非難をぶつける。しかしこうして学んで見ると、傲慢で非科学的なのはむしろ彼らだ、という思いを強くする。そして計算高い人たちだ。 (誰のための科学でなんのための学問か。彼らにとっては立身出世のための道具でしかない。) 「フクシマ放射能危機」はますますその深化・拡大するに違いない。かなりの焦燥感をもって私はそう感ずる。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| (以下第10章「被曝に伴う“がん”のリスク 第1部:初期の証拠」に続く) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||